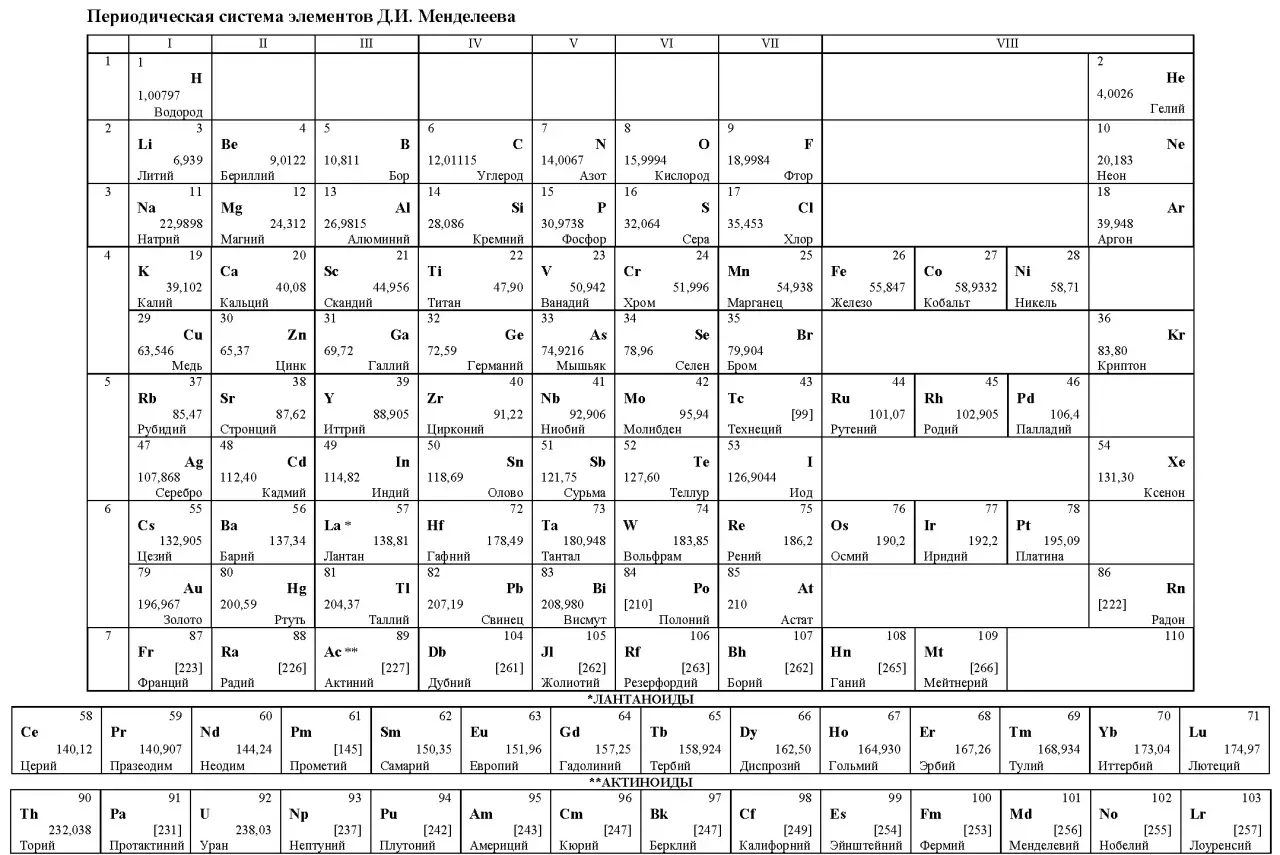
Периодическая система химических элементов, также известная как таблица Менделеева — это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда их атомного ядра. Это система организации химических элементов, является графическим выражением периодического закона, открытого в 1869 году русским химиком Дмитрием Ивановичем Менделеевым.
Таблицу Менделеева можно использовать для решения задач и заданий по химии на ЕГЭ 2024. Картинка масштабируется и увеличивается на смартфонах.
Расшифровка таблицы Менделеева
Закон Менделеева — свойства простых веществ и соединений элементов находятся в периодической зависимости от величины их атомной массы (заряда ядра).
- Атом — электронейтральная мельчайшая частица, состоящая из положительно заряженного ядра (протоны) и отрицательно заряженной оболочки (электроны).
- Элемент — совокупность атомов с одинаковым зарядом ядра.
- Молекула — нейтральная по заряду наименьшая совокупность атомов, связанных химическим взаимодействием, несущая химические свойства.
- Ион — частица с положительным (катион) или отрицательным (анион) зарядом, не имеющая неспаренных электронов.
- Радикал — атом, имеющий неспаренные электроны.
- Вещество — совокупность атомов или молекул в твердом, жидком или газообразном состоянии. Бывает простым (один вид атомов) и сложным (несколько видов атомов).
- Смеси — состоят из разных видов атомов или молекул.
- Окислитель — атом, молекула или ион, принимающий электроны. Окислитель восстанавливается в реакции.
- Восстановитель — атом, молекула или ион, отдающий электроны. Восстановитель окисляется в реакции.
- Электроотрицательность — способность атома притягивать к себе электроны.
- Степень окисления — условный заряд атома в молекуле.
- Энергия ионизации — энергия, необходимая для отрыва электронов от атома элемента.
- Изотопы — разновидности атомов элемента с одинаковым числом протонов и разным числом нейтронов.
Ядерные реакции:
- α-распад — испускание альфа-частиц ядром
- β-распад — испускание бета-частиц ядром
- γ-излучение — испускание электромагнитных волн ядром
Альфа-распад — процесс, при котором ядро испускает частицу альфа (ядро гелия), уменьшая свою массовое число на 4 единицы и заряд на 2 единицы. Бета-распад — процесс, при котором ядро испускает электрон (β-) или позитрон (β+), изменяя свою зарядовую составляющую. Гамма-излучение — испускание энергетических фотонов гамма-квантов без изменения состава ядра.
- Период полураспада — время, за которое распадается половина начального количества атомов радиоактивного изотопа.
- Порядковый номер элемента — число протонов в ядре атома, определяет заряд ядра.
- Относительная атомная масса (атомное число) — отношение массы атома к 1/12 массы атома углерода-12.
- Моль — количество вещества, содержащее число структурных частиц (атомов, молекул), равное числу атомов в 12 г углерода-12.
Электронные оболочки атомов имеют энергетические уровни и подуровни. Орбитали заполняются электронами в порядке возрастания энергии согласно правилам Клечковского, Паули и Хунда.
Электрон описывается четырьмя квантовыми числами: главным (n), орбитальным (l), магнитным (m) и спиновым (s). Эти числа определяют положение электрона на орбитали.
Свойства элементов периодически изменяются с заполнением электронных оболочек. Увеличивается металличность по группам снизу вверх и слева направо, а неметалличность — справа налево и сверху вниз.
Положение элемента в таблице Менделеева определяется зарядом ядра (порядковым номером). Элементы расположены по возрастанию этого числа. Строки таблицы — периоды, столбцы — группы.